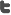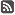UE 2013: 81 de medicamente, recomandate pentru aprobare. România nu vede, nu aude, nu e interesată.
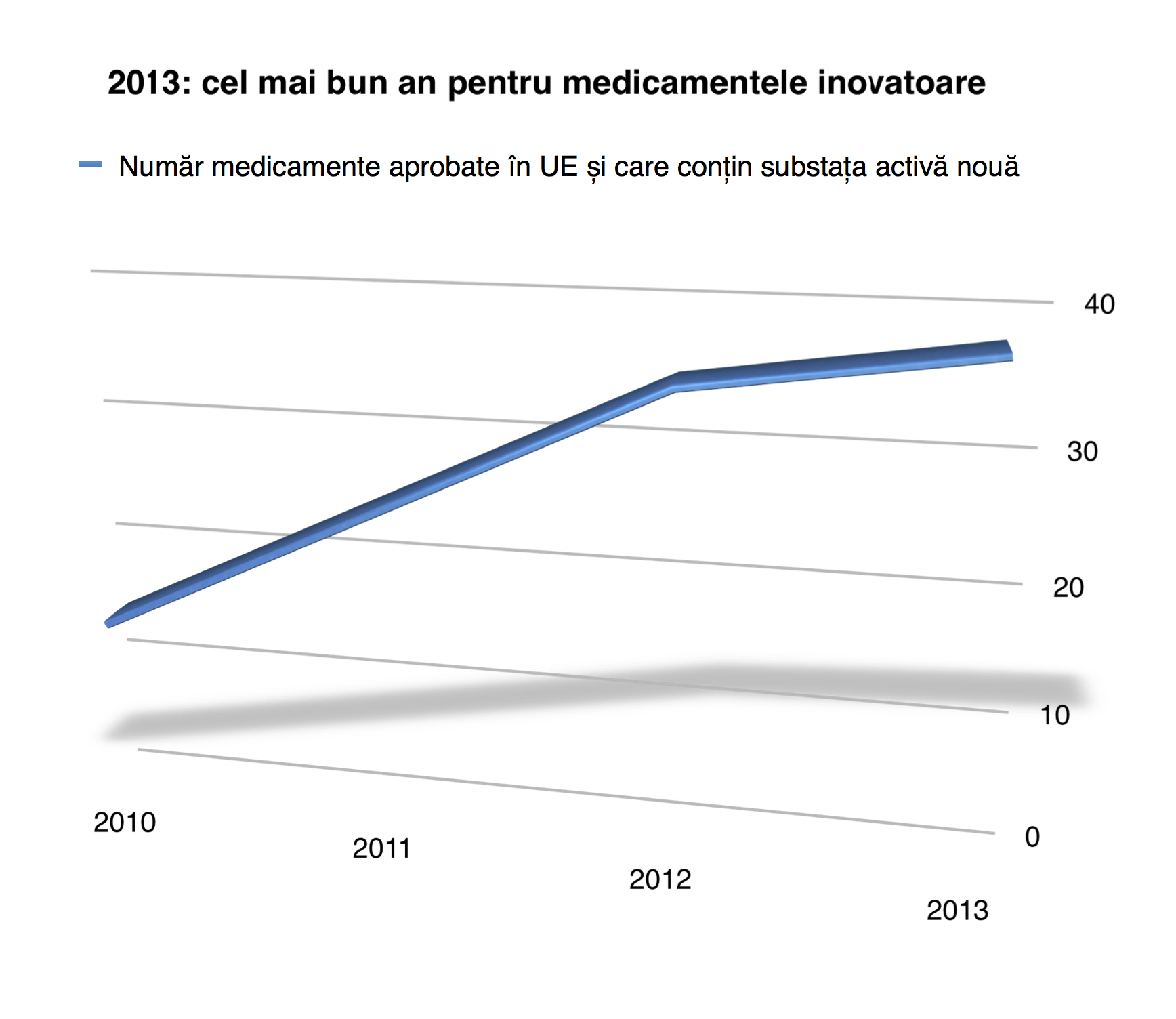
Anul trecut, Comitetul pentru Produse Medicinale de Uz Uman al Agenției Europene a Medicamentului a recomandat 81 de medicamente, față de numai 57 în anul 2012. Dintre acestea, 38 conțin substanțe active complet noi, care n-au mai fost folosite anterior.
Numărul medicamentelor generice supuse aprobării a fost similar cu cel din 2012. Pe de altă parte, 11 dintre cele 81 de medicamente sunt pentru tratamentul bolilor rare (față de 4, în 2011, și 8, în 2012), indicând succesul reglementărilor inițiate de Comisia Europeană în anul 2000 în privința producței medicamentelor orfane.
Unul dintre aceste medicamente orfane se adresează tuberculozei rezistente la tratament, capitol la care România ocupa locul I în Europa.
De reținut: în 2013 au fost și primele două aprobări pentru medicamente biosimilare cu structură de anticorpi monoclonali.
16 dintre cele 81 de medicamente se adresează cancerului, 13 dintre acestea conținând substanțe active absolut noi. Cele mai multe dintre aceste medicamente noi sunt terapii țintite, care blochează specific o cale de dezvoltare tumorală sau care acționează asupra sistemului imunitar al pacientului oncologic.
Tot în 2013, a fost recomandată aprobarea condiționată sau prin procedură excepțională pentru 9 medicamente (dintre care 3 pentru bolnavii cu cancer – Bosulif, Erivedge, Cometriq). Prin aceste proceduri, Comisia Europeană își propune scurtarea drumului de la laborator la patul bolnavului pentru acele terapii care-și dovedesc eficiența timpuriu, în cursul desfășurării unui studiu clinic.